Cercetare & studii clinice

Scurtă prezentare a activității de cercetare înainte de autorizarea medicamentului – studii clinice
Ce sunt studiile clinice?
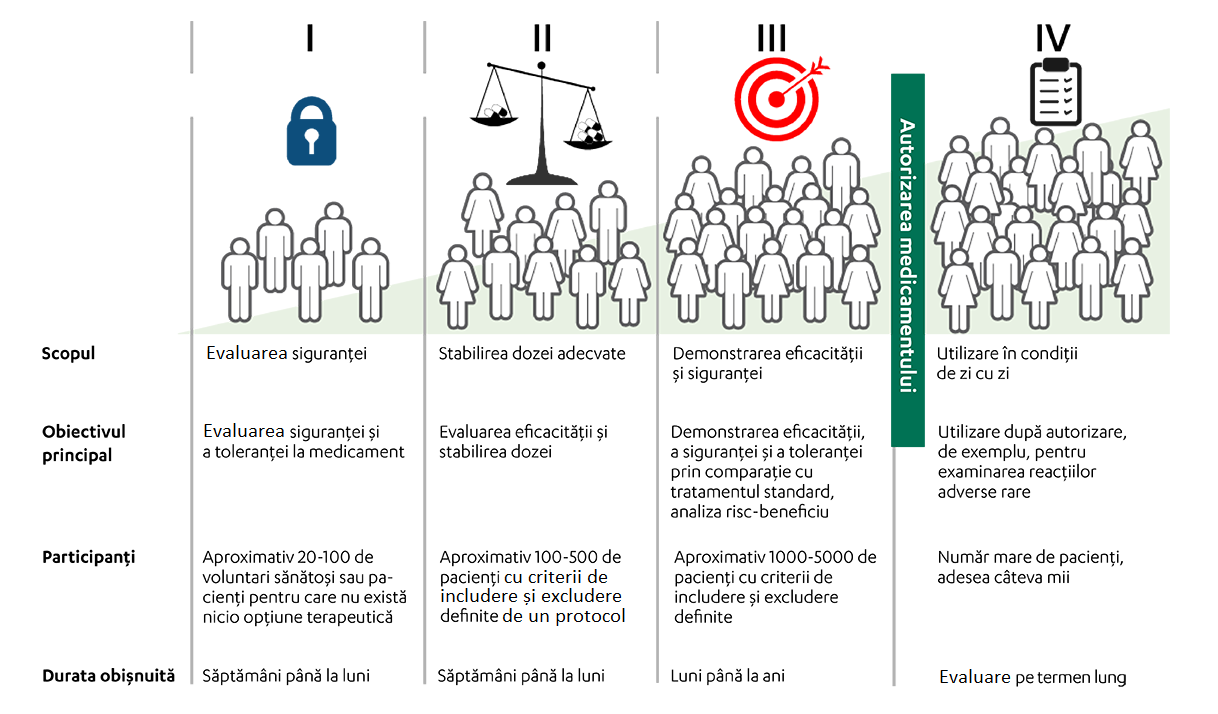
Există patru faze ale studiilor clinice:
Care este scopul studiilor clinice?
Înainte ca un medicament să fie pus pe piață sau autorizat pentru tratamentul unei boli, eficacitatea și siguranța acestuia trebuie dovedite în cadrul unor studii, cunoscute și sub numele de studii clinice sau trialuri clinice.
După autorizare (adică după obținerea autorizației de punere pe piață), pot fi necesare studii suplimentare pentru a obține informații adiționale în legătură cu un anumit medicament.
În calitate de companie de cercetare în domeniul sănătății, Janssen se angajează să respecte standarde înalte în activitatea de cercetare și dezvoltare. Studiile noastre clinice respectă cu strictețe cerințele științifice, legale și etice. Siguranța și protecția persoanelor care iau parte la studii reprezintă prioritatea noastră.
În România, fiecare studiu clinic trebuie aprobat de către Agenția Națională a Medicamentului și a Dispozitivelor Medicale, în funcție de medicament și de tipul de studiu, și trebuie să fie supus avizului unui comitet de etică.
Fazele studiilor clinice înainte de autorizarea unui medicament (faza I-III)
Faza I
În studiul clinic de fază I, un anumit medicament este administrat pentru prima oară subiecților umani pentru a investiga toleranța, siguranța și farmacocinetica substanței active în organism. Un număr redus de participanți este inclus în studiul de fază I, în general aceștia fiind voluntari sănătoși
Se colectează date inițiale privind siguranța și doza maximă tolerată. De obicei, se investighează și proprietățile farmacocinetice ale substanței - adică distribuția și excreția în organism, precum și influența alimentelor și interacțiunile cu alte substanțe active.
După o evaluare favorabilă a raportului risc-beneficiu, medicamentul propus poate intra în faza a II-a a studiilor clinice.
Faza II
În această fază, se examinează administrarea medicamentului la pacienții care suferă de o anumită boală. Numărul de pacienți inclus în această fază este unul limitat, iar scopul este testarea eficacității dozei propuse pentru tratamentul respectivei boli.
Faza III
După ce medicamentul a trecut cu succes de faza II, studiile de fază III investighează eficacitatea și toleranța la medicamentul de studiu și continuă evaluarea raportului risc-beneficiu. Un grup mai mare de participanți face posibilă o evaluare îmbunătățită a reacțiilor adverse mai puțin frecvente.
Studiile clinice care au ca obiectiv solicitarea autorizării medicamentului se desfășoară sub forma așa-numitelor studii randomizate controlate, în care pacienții sunt împărțiți în două grupuri de tratament. În cadrul unui grup de tratament, se alege forma de administrare și doza medicației de studiu în vederea utilizării pe piață. Comparația se face, de obicei, cu un braț de tratament de control în care pacienții primesc terapia standard utilizată în mod obișnuit pentru boala respectivă. Pacienții sunt repartizați în mod aleatoriu într-unul dintre grupurile de tratament (randomizare).
Ce se întâmplă după ce un medicament a fost autorizat?
După ce un medicament a fost autorizat, studiile clinice se numesc și studii de fază IV. Studiile asupra medicamentului autorizat servesc la obținerea de date suplimentare pe populații mari de pacienți. Astfel, studiile de fază IV sunt efectuate cu indicația terapeutică, doza și forma de administrare aprobate. Adesea, un obiectiv este acela de a putea înregistra reacțiile adverse care apar rar sau interacțiunile cu alte medicamente. În funcție de problematica abordată, se iau în considerare grupuri speciale de pacienți, cum ar fi copiii, persoanele în vârstă sau pacienții cu un anumit istoric clinic sau o expunere specifică.
Scurtă prezentare a activității de cercetare după autorizarea medicamentului
Ce sunt studiile non-intervenționale/ studiile observaționale și de ce se efectuează acestea?
Un studiu non-intervențional sau un studiu observațional examinează modul în care un medicament își dovedește eficacitatea în condiții de utilizare zilnică după ce a fost aprobat. Spre deosebire de studiile intervenționale, care observă o populație de pacienți clar definită, în conformitate cu reguli stricte, în studiile observaționale medicul își tratează pacienții exact în același mod în care ar face-o în mod obișnuit și documentează doar parcursul tratamentului, adică, de exemplu, ce medicament prescrie medicul pentru pacient și la ce ore este administrat medicamentul.
Din acest motiv, vorbim și de studii non-intervenționale. Obiectivul unui studiu observațional sau non-intervențional este acela de a se asigura că datele colectate oferă o imagine completă a rutinei de tratament. Deoarece chiar și după ce un medicament a fost aprobat, este important să se obțină informații cu privire la eficacitatea și reacțiile adverse rare ale unui medicament și, prin urmare, să se colecteze date cu privire la acestea. De altfel, aceasta este și intenția autorității legislative, care poate chiar să dispună, în anumite cazuri, efectuarea unui studiu observațional.

Ce tratament primește pacientul în timpul unui studiu observațional?
Participarea la un studiu observațional nu are niciun efect direct asupra pacientului: acesta primește exact tratamentul pe care i l-ar fi prescris medicul - independent de studiul observațional. Datele cu caracter personal colectate în cadrul unui studiu observațional pot fi utilizate numai dacă pacientul și-a dat consimțământul în acest sens. Prin participarea la studiu, pacientul are o contribuție importantă la aprofundarea cunoștințelor privind terapia și a evoluției bolii, dându-și acordul ca datele sale privind tratamentul să fie documentate și evaluate pentru studiul non-intervențional (observațional).
Care sunt regulile pentru un studiu observațional?

Efectuarea studiilor observaționale se supune unor reguli stricte. Acestea includ standarde de calitate: în plus față de consimțământul pacientului după o informare detaliată, studiul observațional trebuie să fie avizat de un comitet de etică independent.
Standardele științifice sunt reglementate de normele naționale și europene la care Janssen a aderat.
Medicul primește bani pentru studiu?
Da, medicul primește un onorariu pentru munca suplimentară pe care o presupune documentarea din cadrul studiului. Valoarea onorariului este clar reglementată și se bazează pe baremul de onorarii pentru medici. Onorariul este stabilit în așa fel încât să nu existe niciun stimulent pentru prescrierea preferențială sau recomandarea anumitor medicamente. Remunerația acordată este transparentă: aceasta este raportată la Agenția Națională a Medicamentului și Dispozitivelor Medicale.
În concluzie, studiile observaționale sau studiile non-intervenționale extrag date dintr-un număr mare de pacienți și prin urmare completează studiile clinice efectuate pre-autorizare. Acestea oferă informații valoroase despre aplicabilitatea practică și adecvarea în viața de zi cu zi a noilor medicamente.
Ce presupune pentru pacient participarea la un studiu clinic?
LA CE MĂ POT AȘTEPTA DACĂ PARTICIP LA UN STUDIU CLINIC?
Dacă sunteți interesat să participați la un studiu clinic, medicul dumneavoastră va trebui să parcurgă împreună cu dumneavoastră un document foarte detaliat despre studiu, conform cerințelor legale. Acest document se numește "Formular de informare și consimțământ al pacientului". Scopul acestui document este de a se asigura că:
- înțelegeți pe deplin procesul de desfășurare a studiul clinic, inclusiv toate procedurile, posibilele reacții adverse și alte riscuri care pot fi asociate cu participarea la studiu sau cu desfășurarea acestuia.
- sunteți conștient de responsabilitățile pe care le aveți în calitate de participant la studiul clinic
- vi se răspunde la toate întrebările cu privire la studiul clinic
- știți că puteți părăsi studiul clinic în orice moment, fără a oferi niciun motiv.
De asemenea, sunt explicate multe alte aspecte, cum ar fi cele legate de protejarea prin asigurare și protecția datelor. Orice întrebări rămase pe care le aveți după ce ați citit informarea pentru pacienți pot fi discutate în detaliu cu medicul dumneavoastră. După discuție, veți avea timp să decideți dacă doriți să participați la studiu. Dacă decideți să participați, va trebui să semnați formularul scris de consimțământ exprimat în cunoștință de cauză.
CE SE ÎNTÂMPLĂ DACĂ MĂ RĂZGÂNDESC?
Chiar dacă v-ați dat consimțământul de a participa la studiul clinic, vă puteți răzgândi oricând și puteți înceta participarea la studiul clinic în orice moment. Nu este necesar să vă motivați decizia.
EXISTĂ COSTURI DE PARTICIPARE?
Nu. Dacă sunteți eligibil pentru participarea la studiul clinic, veți primi gratuit medicamentul de studiu și toată asistența legată de studiu.
Ce aspecte ar trebui să discut cu medicul meu?
Lista de verificare:
- Care este obiectivul specific al studiului clinic?
- Cum este planificată desfășurarea studiului?
- Cine finanțează studiul?
- Voi suporta vreun cost ca urmare a participării la studiu?
- Există o compensație pentru cheltuieli?
- A fost încheiată o asigurare pentru voluntari?
- Cât timp presupune participarea?
- Ce obligații sunt asociate cu participarea la studiu?
- Este necesară o monitorizare mai îndelungată după încheierea studiului?
- Care sunt beneficiile și riscurile participării la studiu în comparație cu terapiile aprobate?
- Ce experiență este deja disponibilă pentru noua terapie?
- Ce reacții adverse pot să apară?
- Cine este responsabil pentru supravegherea studiului?
- Cine poate fi contactat în caz de urgență sau dacă apar întrebări?
- Ce date vor fi colectate, prelucrate și stocate?
- La ce restricții trebuie să mă aștept la începutul sau în timpul studiului clinic (de exemplu, fără sarcină, fără alcool)?
- Ce se întâmplă dacă studiul se încheie înainte de termen?
- Dacă este necesar: cum poate fi continuat tratamentul după terminarea studiului?

Mai multe informații despre studiile clinice pot fi găsite pe website-ul Agenției Naționale a Medicamentelor și Dispozitivelor Medicale.